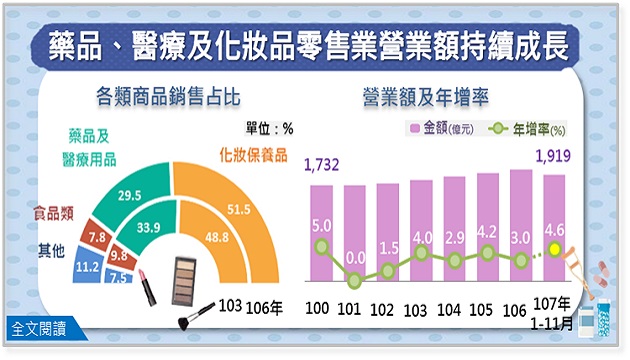
(圖/翻攝自網路)
衛生福利部食品藥物管理署(以下簡稱食藥署)為協助加速新藥研發上市,促使國人及早取得新穎且有效之新藥,兼顧國內生技醫藥產業發展,於106年8月10日公告相關藥品臨床試驗計畫審查流程精進措施。
本次公告的三項具體精進措施,包括簡化首次使用於人體(First in human)的藥品臨床試驗計畫審查流程、訂定細胞治療/基因治療產品臨床試驗計畫快審機制及加強藥品臨床試驗計畫變更案之分級管理,分流審查。
透過這些精進措施,精簡藥品臨床試驗計畫審查流程,並依案件風險程度分級管理,讓技術審查人力做有效配置運用,在兼顧臨床試驗安全性與科學性的前提下,可進一步縮短審查時間,提升臨床試驗審查時效,有助我國參與臨床試驗國際競爭力的提升。此外,針對屬多國多中心(須包含十大先進國)、非首次使用於人體,及同實驗室製程產品於國內已執行過臨床試驗、申請主持人發起之學術研究用細胞治療/基因治療產品臨床試驗,增訂30天的快審機制,以鼓勵國內新興再生醫療產品之研發。
生技醫藥發展除提升醫學研究能量及促進產業發展外,關乎民眾接受創新醫療的機會,食藥署將透過持續不斷檢視及精進我國的臨床試驗法規環境、審查制度及審查效能,協助促進新藥研發上市,嘉惠民眾健康福祉。
公告時間:2017-08-10
文章來源:http://www.mohw.gov.tw/cp-16-37142-1.html